Základy Stereochémie
Aby vám molekuly nepokrútili hlavu!
Základné pojmy
Určite sa nevyhnete týmto pojmom, ktoré si vysvetlíme pekne po poradí:
- Chiralita
- Enantioméry
- Stereogénne centrum
- Diastereoméry
Chiralitu určujeme a hovoríme o nej, ak v určitej zlúčenine existuje uhlík, ktorý má na seba naviazané 4 rôzne substituenty vrátane vodíka. Takýto uhlík nazývame stereogénne centrum
, pretože on určuje či je naša molekule chirálna, alebo nie. A čo to vlastne chiralita je? Chirálne látky sú schopné otáčať rovinu polarizovaného svetla o presný uhol doprava alebo doľava, nazývame ich
enantioméry . Enantioméry , tak ako všetky chirálne látky vo svojej molekule nemajú rovinu alebo stred súmernosti, môžu však mať rotačnú os súmernosti (pozri obrázok).
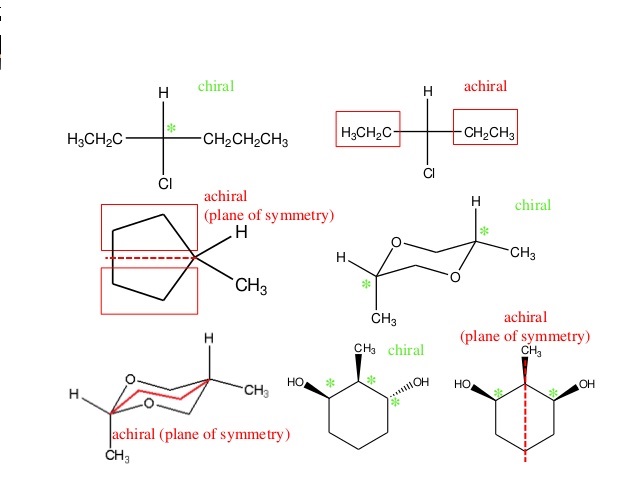
Na obrázku vidíme, že molekuly s rovinou súmernosti sú achirálne . Enantioméry , teda látky so stereogénnym centrom, bez roviny súmernosti, vždy existujú ako dva zrkadlové obrazy, takisto ako naša ľavá
a pravá ruka, jeden otáčajúci
rovinu polarizovaného svetla doprava a druhý doľava, podľa tohto sa rozdeľujú na takzvané (+) enantioméry (otáčajú doprava) a (-) enantioméry (otáčajú doľava), dôležité je však nepliesť si optickú aktivitu daného enantioméru
s konfiguráciou jeho stereogénneho centra, ktorá sa určuje samostatne na R alebo S konfiguráciu, podľa usporiadania substituentov na danom stereogénnom centre.
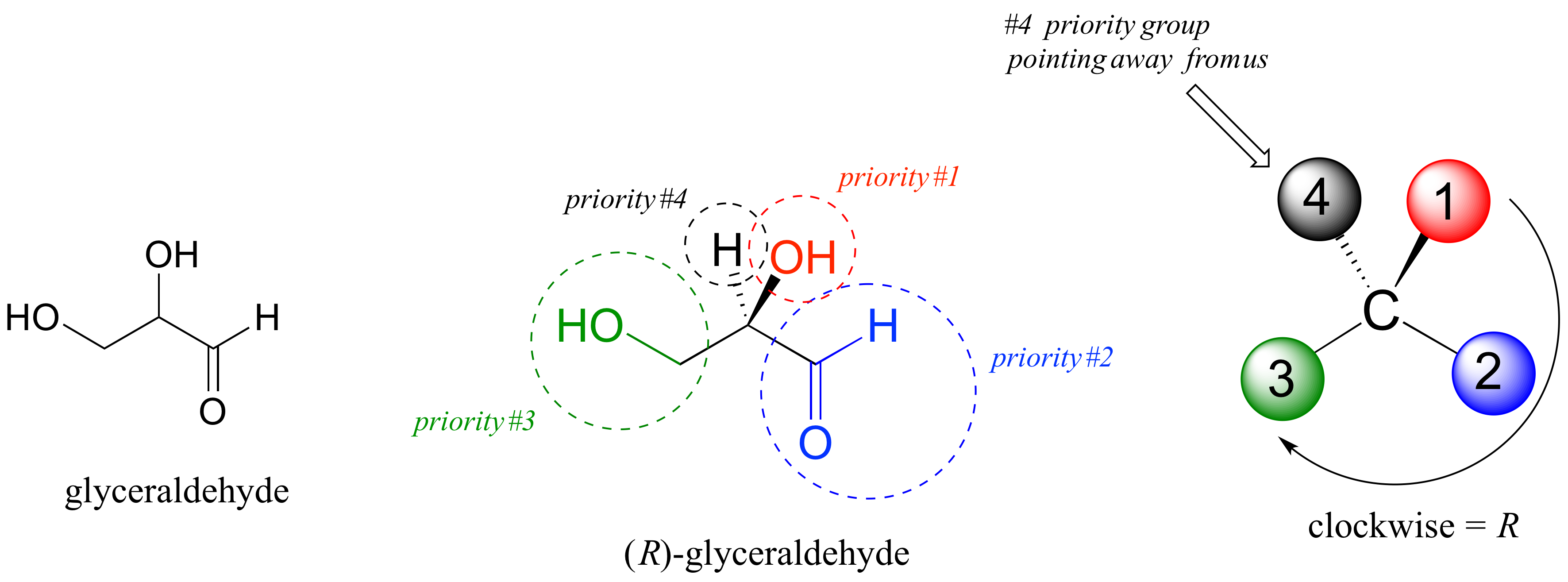
Obrázok vyššie na jednoduchom príklade chirálnej molekuly glyceraldehydu predstavuje, ako určujeme absolútnu konfiguráciu na stereogénnom centre. Najprv je dôležité si určiť samotný chirálny uhlík, ktorý je v tomto prípade druhý uhlík v reťazci, zistíme to spočítaním rozličných substituentov, ak spĺňa podmienku, že sú štyri, ide o stereogénne centrum. Následne zistíme, či je molekula chirálna, hľadaním pomyselnej roviny súmernosti, ktorú ak nenájdeme, hovoríme o chirálnej molekule, čo je aj tento prípad. Následne si musíme zoradiť substituenty na chirálnom uhlíku podľa ich "priority", a to na základe ich protónového čísla, teda v našej molekule glyceraldehydu vidíme, že najväčšie protónové číslo (8), a teda prioritu číslo 1 má kyslík hydroxylovej skupiny, najnižšiu prioritu má vždy vodík, keďže jeho protónové číslo je najnižšie zo všetkých (1), čo však urobíme so zvyšnými dvoma uhlíkmi naviazanými na naše chirálne centrum? Ich prioritu zistíme, keď sa pozrieme na ďalšie substituenty naviazané priamo na nich a vidíme tam aldehydovú skupinu na jednom a hydroxylovú skupinu na druhom. Karbonylová skupina, alebo dvojitá väzba na akýkoľvek atóm sa v zmysle stereochémie uvažuje ako dva také atómy, a preto má karbonylová skupina prednosť (2 kyslíky sú viac ako 1 kyslík, však?). Podľa tohto postupu teda priradíme čísla k jednotlivým substituentom a nakreslíme si geometrický štruktúrny vzorec našej molekuly tak, aby substituent s najvyššou prioritou bol v predu (tučná čiara) a substituent s prioritou najnižšou vzadu (prerušovaná čiara), teraz sa pozrieme na vytvorený geometrický vzorec a vytvoríme si pomyselnú čiaru od priority 1 po prioritu číslo 3, čo nám dá akýsi kruh, ktorého otáčanie sprava do ľava, respektíve zľava do prava, nám určí absolútnu konfiguráciu stereogénneho centra, a teda R pre doprava, S pre doľava. Pre jednoduchšie určovanie je dobré si predstaviť otáčanie volantu auta a podľa neho sa lepšie zorientovať, kam sa vlastne naša "čiarka" otáča. Treba si pamätať, že optická otáčavosť a absolútna konfigurácia stereogénneho centra nemajú nič spoločné, R aj S enantioméry majú oba rovnakú šancu otáčať rovinu polarizovaného svetla doprava, alebo doľava, optická otáčavosť sa môže určovať len pomocou meraní!
Posledným základným pojmom sú Diasteoreoméry , niekde uvádzané aj ako diastereoizoméry. Diastereoméry môžu byť chirálne aj achirálne, a tvoria jednu z možností konfigurácie pri viacerých stereogénnych centrách
v jednej molekule. Napríklad, ak máme v molekule dve stereogénne centrá a náš enantiomér má konfiguráciu RS, jeho zrkadlový obraz, a teda druhý enantiomér je SR (úplne prevrátená konfigurácia), no diastereomér k nemu bude mať
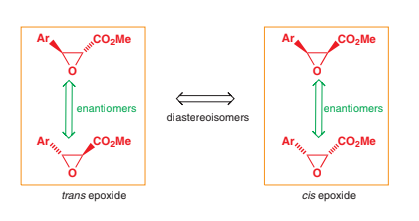
konfiguráciu RR (čiastočne prevrátená) a zároveň môže mať vlastný zrkadlový obraz (keďže je to tiež enantiomér) s konfiguráciou SS. Tento vzťah môže znieť zložito, no pre lepšie pochopenie môže pomôcť nižšie uvedený obrázok, ktorý
ukazuje vzájomný vzťah enantiomérov a diastereomérov. Samozrejme, diastereoméry môžu byť aj achirálne, v tom prípade nebudú mať svoj vlastný enantiomér. Všimnite si, že všetko sú to molekuly s rovnakým empirickým (sumárnym) vzorcom
a líšia sa len a len priestorovou konfiguráciou. Dôležitým faktom je, že kým dva enantioméry sú po fyzikálnych vlastnostiach neodlíšiteľné, okrem otáčania roviny polarizovaného svetla (jeden je (-) a druhý (+)), k nim prislúchajúci
diastereomér sa od nich výrazne líši fyzikálnymi vlastnosťami ako sú teplota topenia, varu a podobne, to platí aj pri molekulách na obrázku.
Počet všetkých možných konfigurácii v molekule vieme jednoducho vypočítať zo vzorca 2n, kde n predstavuje počet stereogénnych centier. Pri použití tohto vzorca je však dôležité si uvedomiť, že nám dáva len celkovú sumu všetkých konfigurácii, zahŕňajúc diastereoméry a enantioméry týchto diastereomérov, pre presnejšie určenie počtu diastereomérov, keďže niektoré môžu byť dokonca achirálne, je dobre si ručne vypísať všetky možné konfigurácie, pospájať sebe zrkadlovo obrátené enantioméry a oddeliť ich od ostatných takýchto "dvojičiek". Počet týchto "dvojičiek" je potom počet diastereomérov.